اپی ژنتیک
اپی ژنتیک
آیا امکان این که برخی صفات اکتسابی از طریق نسل ها منتقل شوند وجود دارد؟ چنین نظری در قرن نوزدهم رایج شد و اولین بار توسط لامارک دانشمند فرانسوی پیشنهاد شد اما این نظریه با پیدایش ژنتیک کلاسیک و تکامل داروینی از اعتبار ساقط شد. آخرین میخ تابوت تکامل لامارکی کشف DNA در سال ۱۹۵۳ بود. به نظر می رسد این مولکول کارآمد و منظم که رمز هایی برای حیات را در توالی های بسته بندی شده ای به نام ژن حمل می کند ثابت می کند که تنها یک خصوصیت ژنتیکی مثل رنگ چشم می تواند به ارث برسد.
برای دانشمندان علم ژنتیک والدین و اجداد تنها به عنوان افرادی که ژن هایشان را انتقال داده اند اهمیت دارند و نوع زندگی شان در این مورد نقشی ندارد اما گروه دیگری از دانشمندان اکنون دلایل قانع کننده ای ارائه کرده اند که پیشنهاد می کند توارث ممکن است به واقع آنقدر که ژنتیک دان های کلاسیک معتقدند، ساخته و پرداخته نباشد. این نظریه اپی ژنتیک نامیده می شود.
برای دانلود مقاله کامل کلیک کنید
آمنیوسنتز
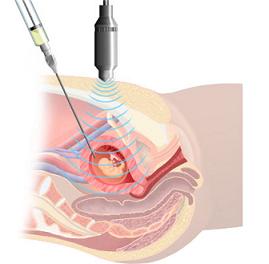
یک تکنیک پزشکی تشخیص قبل از تولد میباشد که در طی آن مقدار کمی از مایع آمنیون گرفته شده و بررسی ژنتیکی بر روی آن انجام میگیرد. این شیوه معمولاً در سه ماههٔ دوم انجام میگیرد.آمنیوسنتز یکی از رایج ترین روشهای تهاجمی تشخیص پره ناتال در سه ماه ی دوم بارداری است . آمنیوسنتز برای همه مادران باردار توصیه نمیشود بلکه تنها در مادرانی انجام میگیرد که سن آنان بالای ۳۵ سال باشد و یا در بررسی غربالگری سندرم داون یا شیوههای دیگر غربالگری در زمره بارداریهای پر خطر طبقه بندی شده باشند. آمنیوسنتز علاوه بر بررسی از نطر سندرم داون و بیماری های کروموزومی به منظور تعیین وضعیت جنین از نطر ابتلا به سایر بیماری های ژنتیکی نیز کاربرد دارد. ذر این موارد می بایست وضعیت ژنتیکی خانواده و افراد مبتلا از قبل تعیین شده باشد. از جمله علل مهم برای انجام آمنیوسنتز می توان به
- سن بالای 35 سال مادر
- سطح غیر طبیعی مارکرهای بیوشیمییایی
- نتایج غیر طبیعی در سونوگرافی
- سابقه ی فامیلی مثبت برای اختلالات ژنتیکی
- حاملگی هایی با ریسک ناهنجاری های کروموزومی اشاره کرد
شیوههای تشخیص پیش از تولد
 |
شیوههایی که در حال حاضر برای تشخیص پیش از تولد بکار میروند شامل روشهای تهاجمی و غیر تهاجمی میباشد. شیوههای تهاجمی شامل آمینوسنتز ، نمونه برداری از پرزهای کوریونی ، کوردوسنتز و تشخیص ژنتیکی پیش از لانه گزینی میباشد. شیوههای غیر تهاجمی شاملآلفافیتوپرتئین سرم مادر ، غربالگری سرم مادر ، سونوگرافی و جدا کردن سلولهای جنینی از گردش خون مادر میباشد. که برخی از آنها را در زیر توضیح میدهیم.
آزمایشهای تهاجمی
آمینوسنتز
آمینوسنتز به خارج کردن نمونهای از مایع آمنیوتیک از راه شکم ، توسط سرنگ اطلاق میشود. مایع آمنیوتیک ، حاوی سلولهایی از منشا جنینی است که میتوان آن را برای آزمایشهای تشخیصی کشت داد. پیش از آمینوسنتز ، از سونوگرافی برای تایید قابلیت حیات جنین ، سن بارداری ، تعداد جنینها و طبیعی بودن ساختمانها و.. استفاده میشود. آمینوسنتز به صورت سرپایی و عموما در هفتههای 16 - 15 پس از اولین روز آخرین دوره قاعدگی ، انجام میشود. علاوه بر تجزیه و تحلیل کروموزومهای جنین ، میتوان غلظت AFP در مایع آمینوتیک را جهت شناسایی بعضی بیماریها ، ارزیابی کرد.AFP ، نوعی گلیکوپروتئین جنینی است که عمدتا در کبد تولید میشود و به داخل جریان خون جنین منتقل میشود و توسط کلیهها از راه ادرار به مایع آمنیوتیک دفع میگردد. AFP از طریق جفت ، پردههای آمینوتیک و گردش خون مادری - جنین ، وارد جریان خون مادر میشود. بنابراین میتوان آن را در مایع آمینوتیک یا سرم مادر سنجید. هر دو سنجش در تشخیص پیش از تولد بسیار مفید هستند. اگر غلظت این گلیکوپروتئین زیاد باشد، نشان دهنده بعضی اختلالات در جنین میباشد. در آزمایش آمینوسنتز ، احتمال پاره شدن پرده آمینوتیک و سقط جنین وجود دارد.
کوردوسنتز
کوردوسنتز ، روشی است که برای بدست آوردن مستقیم نمونه خون جنینی از بند ناف با هدایت سونوگرافی بکار میرود. نمونه خون جنینی صرفا به چند روز کشت نیاز دارد تا سلولهای مناسب برای تجزیه و تحلیل کروموزومی یا مطالعات خونی فراهم شوند. کوردوسنتز برای پیگیری سونوگرافی که وجود اختلال جنینی را نشان داده است. در مواردی بکار میرود کشت سلولهای مایع آمینوتیک ناموفق بوده یا وقتی تشخیص DNA برای اختلالی که با آزمایشهای بیوشیمیایی سلولهای پلاسما یا خون جنین قابل شناسایی است، امکان پذیر نیست. کوردوسنتز در هفتههای 21 - 19 بارداری انجام میشود و میزان سقط جنین در این روش 3 - 2 درصد است.کاربردهای اصلی تشخیص پیش از تولد با آزمایشهای تهاجمی
- سن بالای مادر: در سن 35 سالگی ، خطر وجود اختلال کروموزومی در جنین ، برابر خطر سقط مرتبط با آمینوسنتز است.
- فرزند قبلی دچار نوعی اختلال کروموزومی جدید باشد که والدین این اختلال ندارند و احتمال این اختلال در فرزندان بعدی ، بیشتر است.
- وجود اختلال ساختمانی کروموزمی در یکی از والدین.
- سابقه خانوادگی یک اختلال ژنتیکی که با تجربه و تحلیل بیوشیمیایی یا DNA ممکن است تشخیص داده یا رد شود. اکثر اختلالات این گروه ناشی از نقایص تک ژنی بوده و خطر عود آنها 50 - 25 درصد است.
- سابقه خانوادگی نوعی اختلال وابسته به جنس که هیچ آزمایش تشخیص اختصاصی پیش از تولد برای آن وجود ندارد.
- خطر نقص لوله عصبی ، در این موارد انجام آزمایش آمینوسنتز ، الزامی است.
سونوگرافی
سونوگرافی اهمیت روز افزونی در تشخیص پیش از تولد برای ارزیابی جنین و شناسایی ناهنجاریهای ظاهری دارد. این روش تعیین دقیق سن جنین را مقدور میسازد، بارداریهای چند قلو را شناسایی میکند و قابلیت حیات جنین را تائید مینماید. حتی میتوان از آن در سه ماهه دوم ، برای شناسایی جنس جنین با دقت زیاد استفاده کرد. سونوگرافی از راه شکم که شیوه مرسوم میباشد، امروزه با فراوانی زیادی با سونوگرافی از راه واژن تکمیل میشود تا قابلیت حیات جنین و سن بارداری ارزیابی گردد. ارزیابیهای پیگیری کننده دراز مدت ، نتوانستهاند مدرکی دال بر مضر بودن سونوگرافی برای جنین یا مادر ارائه دهند.سونوگرافی پیش از تولد برای اختلالات تک ژنی
وقتی جنین در معرض خطر نوعی اختلال تک ژنی است که ضایعه ژنتیکی آن ناشناخته میباشد، سونوگرافی جزئی ممکن است گاهی تنها شیوه مقدور تشخیص پیش از تولد باشد. به عنوان مثال ، سندرم مکل - گرابر در حال حاضر صرفا با سونوگرافی قابل تشخیص است. در برخی مواردی که آزمایش DNA امکان پذیر است، اما نمونه خونی یا بافتی برای مطالعات DNA یا پروتئین در دسترس نیست، سونوگرافی تشخیصی میتواند مناسب باشد.پیوند سلول های مغز استخوان
 مغز استخوان ماده ای نرم و اسفنجی شکل است که داخل استخوان ها یافت می شود. این ماده حاوی سلول های نابالغی است که سلول های مادر (cell Stem) نامیده می شود و وظیقه آنها تولید سلول های خونی است. ۳نوع سلول خونی وجود دارد: مغز استخوان ماده ای نرم و اسفنجی شکل است که داخل استخوان ها یافت می شود. این ماده حاوی سلول های نابالغی است که سلول های مادر (cell Stem) نامیده می شود و وظیقه آنها تولید سلول های خونی است. ۳نوع سلول خونی وجود دارد: ● سلول های سفید خون (گلبول های سفید) سلول های قرمز خون (گلبول های قرمز خون ) که اکسیژن را به بافت ها حمل کرده و فرآورده های زائد را از اندام ها و بافت ها جمعآوری می کنند. |
میتوز
 میتوز
میتوز
مرحله میتوز تقسیم یاختهای نسبت به جنبههای دیگر چرخه یاختهای یوکاریوتها توجه بیشتری را به خود جلب کرده است. بر اساس سنتی که وجود داردمیتوز را به چهار مرحله پروفاز ، متافاز ، آنافاز و تلوفاز تقسیم میکنند. این گونه تقسیم بندی آسان به نظر میرسد، اما روند تقسیم حقیقتا پیوسته است و مراحل تقسیم به آرامی از یک مرحله به مرحله دیگر وارد میشود.
را به چهار مرحله پروفاز ، متافاز ، آنافاز و تلوفاز تقسیم میکنند. این گونه تقسیم بندی آسان به نظر میرسد، اما روند تقسیم حقیقتا پیوسته است و مراحل تقسیم به آرامی از یک مرحله به مرحله دیگر وارد میشود.
پروفاز
 اولین مرحله تقسیم یاختهای که با متراکم شدن کروموزومها
اولین مرحله تقسیم یاختهای که با متراکم شدن کروموزومها (که آغاز آن از مرحله
(که آغاز آن از مرحله  است) آغاز میشود و شاید طولانیترین مرحله بوده و چند ساعت طول میکشد،پروفاز نام دارد. متراکم شدن کروموزومها در طی مرحله پروفاز ادامه مییابد. بنابراین کروموزومهایی که در آغاز پروفاز به صورت رشتهای ظریف بودند، در آخر این مرحله کاملا حجیم میشوند. هنگامی که بخشی از کروموزوم که حاوی ژنهای RNA ریبوزومی است، متراکم میشود، سنتز RNA ریبوزومی کاهش مییابد و در نتیجه هستک
است) آغاز میشود و شاید طولانیترین مرحله بوده و چند ساعت طول میکشد،پروفاز نام دارد. متراکم شدن کروموزومها در طی مرحله پروفاز ادامه مییابد. بنابراین کروموزومهایی که در آغاز پروفاز به صورت رشتهای ظریف بودند، در آخر این مرحله کاملا حجیم میشوند. هنگامی که بخشی از کروموزوم که حاوی ژنهای RNA ریبوزومی است، متراکم میشود، سنتز RNA ریبوزومی کاهش مییابد و در نتیجه هستک که قبلا مشخص شود، ناپدید میگردد.در حین متراکم شدن کروموزومها یک سری رویدادهای مهم دیگر رخ میدهد. هستک ناپدید شده و دستگاه ریزلولهای ، جهت جدا کردن کروموزومهای دختر تشکیل میگردد. در اوایل مرحله پروفاز دو جفت سانتریول
که قبلا مشخص شود، ناپدید میگردد.در حین متراکم شدن کروموزومها یک سری رویدادهای مهم دیگر رخ میدهد. هستک ناپدید شده و دستگاه ریزلولهای ، جهت جدا کردن کروموزومهای دختر تشکیل میگردد. در اوایل مرحله پروفاز دو جفت سانتریول از یکدیگر دور میشوند و بین آنها محوری از ریزلولهها
از یکدیگر دور میشوند و بین آنها محوری از ریزلولهها تشکیل میگردد که رشتههای دوک نامیده میشوند. سانتریولها از هم دور میشوند تا در دو قطب مخالف روبروی هم قرار گیرند و پلی از ریزلولهها بین آنها بوجود میآید. در یاختههای گیاهی
تشکیل میگردد که رشتههای دوک نامیده میشوند. سانتریولها از هم دور میشوند تا در دو قطب مخالف روبروی هم قرار گیرند و پلی از ریزلولهها بین آنها بوجود میآید. در یاختههای گیاهی چنین پلی متشکل از رشتههای دوک بین قطبهای مخالف یاخته تشکیل میگردد، اما در این حالت مرکز سازمان دهنده ریزلولهها با میکروسکوپ نوری
چنین پلی متشکل از رشتههای دوک بین قطبهای مخالف یاخته تشکیل میگردد، اما در این حالت مرکز سازمان دهنده ریزلولهها با میکروسکوپ نوری دیده نمیشود.
دیده نمیشود.
 هنگام تشکیل دستگاه دوک ، غشای هسته خرد میشود و مواد آن بوسیله شبکه آندوپلاسمی
هنگام تشکیل دستگاه دوک ، غشای هسته خرد میشود و مواد آن بوسیله شبکه آندوپلاسمی جذب میگردد. بنابراین دوک ریزلولهای از یک قطب به قطب دیگر کشیده میشود. موقعیت دوک صفحه تقسیم را مشخص میکند که از مرکز هسته میگذرد و عمود بر دوک است. هنگامی که سانتریولهاییاختههای جانوری
جذب میگردد. بنابراین دوک ریزلولهای از یک قطب به قطب دیگر کشیده میشود. موقعیت دوک صفحه تقسیم را مشخص میکند که از مرکز هسته میگذرد و عمود بر دوک است. هنگامی که سانتریولهاییاختههای جانوری در حال تقسیم ، به قطبهای یاخته میرسند، در اطراف خود رشتههایی از ریزلولهها را به صورت شعاعی بیرون میفرستند که همانند داربستی سانتریولها را در برابر غشای یاخته نگاه میدارند. این نوع آرایش ریزلولهها را ستاره (آستر) میگویند.
در حال تقسیم ، به قطبهای یاخته میرسند، در اطراف خود رشتههایی از ریزلولهها را به صورت شعاعی بیرون میفرستند که همانند داربستی سانتریولها را در برابر غشای یاخته نگاه میدارند. این نوع آرایش ریزلولهها را ستاره (آستر) میگویند.
یاختههای گیاهی که دیواره سخت یاختهای دارند، فاقد سانتریول هستند. در حین ادامه پروفاز دومین گروه ریزلولهای از هر سانترومر منفرد به قطبهای دوک کشیده ممیشوند. از هر کروموزوم دو ریزلوله خارج میشود که دو طرف سانترومر را به دو قطب دوک متصل میکنند. دو ریزلوله متصل به سانترومر به پیشروی خود ادامه میدهند تا هر دو با دو قطب یاخته تماس حاصل کنند. این امر سبب کشیدگی کرومزومها به خط میانی یاخته میشود. در مرحله پروفاز ATP
دارند، فاقد سانتریول هستند. در حین ادامه پروفاز دومین گروه ریزلولهای از هر سانترومر منفرد به قطبهای دوک کشیده ممیشوند. از هر کروموزوم دو ریزلوله خارج میشود که دو طرف سانترومر را به دو قطب دوک متصل میکنند. دو ریزلوله متصل به سانترومر به پیشروی خود ادامه میدهند تا هر دو با دو قطب یاخته تماس حاصل کنند. این امر سبب کشیدگی کرومزومها به خط میانی یاخته میشود. در مرحله پروفاز ATP به مقدار فراوان مصرف میشود. اگر فهالیت تنفسی یاخته در ابتدای این مرحله متوقف گردد، میتوز
به مقدار فراوان مصرف میشود. اگر فهالیت تنفسی یاخته در ابتدای این مرحله متوقف گردد، میتوز هم متوقف خواهد شد. در اواخر این مرحله ، اگرچه یاخته مقدار زیادی ATP ذخیره میکند، با این وجود کاهش فعالیت تنفسی هیچ اثری بر میتوز ندارد.
هم متوقف خواهد شد. در اواخر این مرحله ، اگرچه یاخته مقدار زیادی ATP ذخیره میکند، با این وجود کاهش فعالیت تنفسی هیچ اثری بر میتوز ندارد.
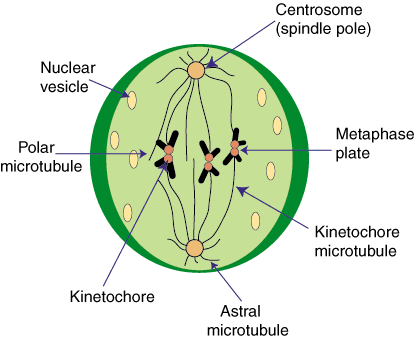
متافاز
دومین مرحله میتوز ، یعنی متافاز ، هنگامی آغاز میشود که کروماتیدهای جفت در مرکز یاخته در یک سطح قرار بگیرند. در این مرحله کروموزومها به آسانی قابل شمارش هستند. ریزلولهها که به دو طرف قطب کشیده شدهاند، آشکارا قابل مشاهدهاند. کروموزومها هم موازی یکدیگر نیستند، بلکه بازوی بلند آنها در هر جهتی قرار میگیرد. سانترومرها به یک فاصله از دو قطب در یک سطح قرار میگیرند.
در تقسیم میتوز کروموزومها ، سانترومرهای خود را بطور غیر فعال دنبال میکنند. هر سانترومر دو طرف دارد و یک ریزلوله سانترومری به هر طرف آن متصل شده و به قطبهای مخالف کشیده میشود. این نظم و ترتیب برای روند میتوز کاملا مهم است. هر اشتباهی در استقرار این ریزلولهها خطرناک است. به عنوان مثال ، اتصال دو ریزلوله سانترومری به همان قطب سبب جدا نشدن کروماتیدهای خواهر و در نتیجه باقی ماندن آنها در همان یاخته دختر میشود.
کروموزومها ، سانترومرهای خود را بطور غیر فعال دنبال میکنند. هر سانترومر دو طرف دارد و یک ریزلوله سانترومری به هر طرف آن متصل شده و به قطبهای مخالف کشیده میشود. این نظم و ترتیب برای روند میتوز کاملا مهم است. هر اشتباهی در استقرار این ریزلولهها خطرناک است. به عنوان مثال ، اتصال دو ریزلوله سانترومری به همان قطب سبب جدا نشدن کروماتیدهای خواهر و در نتیجه باقی ماندن آنها در همان یاخته دختر میشود.
زیست شناسان برای متوقف کردن میتوز در مرحله متافاز ، از مادهای به نام کلشیسیناستفاده میکنند تا ساختار ریختی و تعداد کروموزومها را مطالعه کنند. در بسیاری از گونهها ، اندازه کروموزومها متغیر است. کروموزومهای بزرگتر در بیرون و کروموزومهای کوچکتر در مرکز قرار میگیرند. در این مرحله کروموزومها ضخیم و کوتاهاند. کرومونما به حداکثر انقباض خود میرسد. در پایان مرحله متافاز ، سانترومرها تقسیم میشوند. تقسیم سانترومر همه کروموزومها همزمان صورت میگیرد. شکل استوانهای کروموزومهای متافاز نتیجه محکم کلاف شدن کرومونماست. کوتاه شدن کروموزومهای پروفازی و تبدیل آنها به کروموزومهای متافازی هنگام تقسیم 3 تا 6 برابر است.
همزمان صورت میگیرد. شکل استوانهای کروموزومهای متافاز نتیجه محکم کلاف شدن کرومونماست. کوتاه شدن کروموزومهای پروفازی و تبدیل آنها به کروموزومهای متافازی هنگام تقسیم 3 تا 6 برابر است.
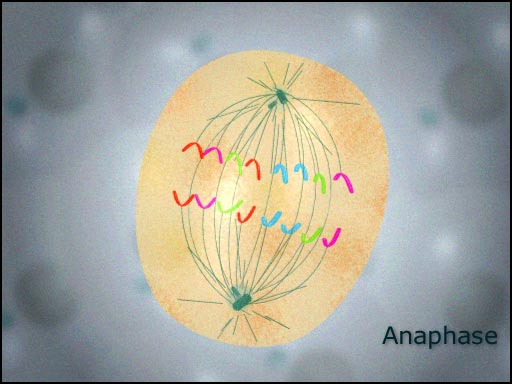
آنافاز
در بین مراحل میتوز ، ATPیرانده شده در اثر تغییرات ساختاری پروتئینهای پل ریزلولههای جفت است. چون هر یک از ریزلولههای جفت از نظر فیزیکی ، به قطبهای مخالف قلاب شدهاند، سر خوردن هر یک از آنها روی دیگری سبب دور شدن قطبها از یکدیگر میشود.سانترومرها به طرف قطبها حرکت میکنند. با جابجا شدن پیاپی اجزای توبولین از انتهاهای قطبی خود ریزلولههای سانترومری کوتاه میشوند. این روند کوتاه شدن ، یک انقباض نیست، چون ریزلولههای سانترومری مرکز تنظیم کننده جابجا میشوند. هر قدر اجزا توبولین بیشتر جابجا شوند، بی نظمی پیشرفته ریزلوله حامل کروموزوم سبب کوتاهتر شدن آن میگردد و کروموزوم را به قطب یاخته نزدیکتر میکشاند. رشتههای اکتین در دوک هم دیده میشوند.
از انتهاهای قطبی خود ریزلولههای سانترومری کوتاه میشوند. این روند کوتاه شدن ، یک انقباض نیست، چون ریزلولههای سانترومری مرکز تنظیم کننده جابجا میشوند. هر قدر اجزا توبولین بیشتر جابجا شوند، بی نظمی پیشرفته ریزلوله حامل کروموزوم سبب کوتاهتر شدن آن میگردد و کروموزوم را به قطب یاخته نزدیکتر میکشاند. رشتههای اکتین در دوک هم دیده میشوند.
تلوفاز
جدا شدن کروماتیدها که در مرحله آنافاز صورت میگیرد، تقسیم صحیح ژنوم همانندسازی شده را که عنصر اصلی میتوز است، کامل میکند. با این تکمیل ایفای نقش تلوفاز که از بین بردن تشکیلات دوک و تشکیل دو هسته است، آغاز میشود. دستگاه دوک متلاشی میشود. ریزلولهها نظم خود را از دست میدهند و به صورت مونرمرهای توبولین در میآیند و آماده استفاده مجدد در ساختار اسکلت یاختهای جدید میشوند.
غشای هسته در اطراف هر گروه کروماتیدهای دختر شکل میگیرد. این کروماتیدها که هنوز به شکل کروموزوماند، شروع به باز شدن میکنند و کاملا کشیده میشوند و به صورت کروماتین تجلی مییابند. یکی از ژنهایی که به سرعت ظاهر میشود، RNA ریبوزومی است که سبب ظهور مجدد هستک میگردد.
تجلی مییابند. یکی از ژنهایی که به سرعت ظاهر میشود، RNA ریبوزومی است که سبب ظهور مجدد هستک میگردد.
سندرم ترنر
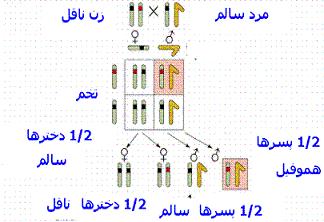
بیماری هموفیلی
بیماری هموفیلی هموفیلی نوعی بیماری ارثی است که در آن خون در محل بریده شده بند نمیآید و جز در موارد استثنایی این بیماری فقط در افراد مذکر دیده میشود. عارضه خونریزی در هموفیلی میتواند بسته به شدت اختلال ژنتیکی درجات مختلفی از نظر شدت داشته باشد. |
انواع هموفیلی
هموفیلی A و B اختلالات انعقادی وابسته به کروموزوم جنسی هستند که به ترتیب بر اثر جهشهایی در ژنهای F8C و F9 ایجاد میشوند. جهشهای F8C موجب کمبود یا اختلال عملکرد عامل انعقادی 8 و جهشهای ژن F9 باعث کمبود یا اختلال عملکرد عامل انعقادی 11 میشوند. هموفیلی نوعی اختلال در تمام نژادها و بدون ترجیح نژادی است. میزان شیوع هموفیلی A از هموفیلی B بیشتر است.
هستند که به ترتیب بر اثر جهشهایی در ژنهای F8C و F9 ایجاد میشوند. جهشهای F8C موجب کمبود یا اختلال عملکرد عامل انعقادی 8 و جهشهای ژن F9 باعث کمبود یا اختلال عملکرد عامل انعقادی 11 میشوند. هموفیلی نوعی اختلال در تمام نژادها و بدون ترجیح نژادی است. میزان شیوع هموفیلی A از هموفیلی B بیشتر است.
شرح بیماری
این بیماری از طریق مادر به پسرانش منتقل شده و مردان خوشبختانه نمیتوانند بیماری را به پسرانشان منتقل کنند. هموفیلی در 85 درصد موارد ناشی از کمبود فاکتور انعقاد خون شماره 8 است و این نوع هموفیلی موسوم به هموفیلی A یا هموفیلی کلاسیک است. در 15 درصد دیگر بیماران هموفیلیک ، تمایل به خونریزی بر اثر کمبود فاکتور انعقادی 11 بوجود میآید. هر دوی این فاکتورها بطور ژنتیکی از طریق کروموزوم X به صورت یک خاصیت مغلوب انتقال مییابند.
بنابراین تقریبا هیچگاه یک زن مبتلا به هموفیلی وجود نخواهد داشت زیرا لااقل یکی از کروموزومهای جنسی او دارای ژنهای سالم خواهند بود. اگر یکی از کروموزومهای جنسی زن معیوب باشد وی یک ناقل هموفیلی خواهد بود و این بیماری را به نیمی از فرزندان پسر خود منتقل خواهد کرد و حالت ناقل بیماری بودن را به نیمی از دختران خود انتقال خواهد داد.
علایم شایع
علایم اولیه هموفیلی خونریزیهای طولانی پس از خراشهای کوچک است. البته عقیده عمومی بر این است که اینگونه خونریزیهای کوچک ولی طولانی باعث مرگ شخص مبتلا نمیشود ولی به تدریج بیماری پیشرفت نموده علایم شدیدتری از قبیل خونریزیهای دردناک داخل مفصلی مانند مفصل زانو ایجاد خواهد کرد.
اینگونه حوادث با کوچکترین تحریکی پیش میآید و احتمالا یک پسر بچه را از انجام بازی محبوبش یعنی فوتبال و یا انجام هر کار کوچک دیگری که احتمال دارد زانو دچار پیچیدگی شود باز میدارد. تجمع خون در مفاصل ممکن است باعث خشک شدن مفصل شده و کودک را بطور کامل فلج کند و یا خونریزیهای غیر منتظرهای در ماهیچهها به وقوع بپیوندد.
به وقوع بپیوندد.
فنوتیپ و سیر طبیعی
هموفیلی معمولا بیماری مردان است هر چند ندرتا خانمها هم به علت انحراف غیر فعال شدن کروموزوم ایکس از حالت طبیعی مبتلا میشوند. از نظر بالینی این دو نوع هموفیلی غیر قابل افتراق هستند. هر دوی اینها با خونریزی به داخل بافتهای نرم ، ماهیچهها و مفاصل متحمل وزن مشخص میشوند. خونریزی ظرف چند ساعت تا چند روز پس از تروما رخ میدهد و اغلب تا چند روز یا چند هفته ادامه مییابد.
آنهایی که بیماری شدیدی دارند معمولا در دوره نوزادی به علت هماتوم شدید سر یا خونریزی طولانی از زخمهای ناف یا محل ختنه تشخیص داده میشوند. افراد دچار بیماری متوسط اغلب تا زمانی که شروع به خزیدن یا راه رفتن نکنند دچار هماتوم نمیشوند و لذا تا آن زمان بیماری آنها تشخیص داده نمیشود.
درمان
اگر چه کار آزماییهای فعلی ژن درمانی بسیار امیدوار کننده به نظر میرسند، هیچ درمانی علاج دهندهای بجز پیوند کبد برای هموفیلی A و B وجود ندارد.
بسیار امیدوار کننده به نظر میرسند، هیچ درمانی علاج دهندهای بجز پیوند کبد برای هموفیلی A و B وجود ندارد.
هر گاه شخص مبتلا به هموفیلی دچار خونریزی شدید و طولانی شود تقریبا تنها درمانی که واقعا موثر است تزریق فاکتور انعقادی شماره 8 خالص است. قیمت این فاکتور بسیار گران بوده و زیاد نیز در دسترس نیست زیرا اولا این فاکتور فقط میتواند از خون انسان و آنهم فقط به مقادیر فوقالعاده اندک بدست آورد. فاکتور 8 که به روش مهندسی ژنتیک تهیه شده به زودی برای مصرف انسانی در دسترس قرار خواهد گرفت.
تهیه شده به زودی برای مصرف انسانی در دسترس قرار خواهد گرفت.
خطر توارث
اگر خانمی سابقه خانوادگی هموفیلی داشته باشد با تجزیه و تحلیل پیوستگی یا شناسایی دو ژن جهش یافته F8C و F9 تجمع یافته در خانواده میتوان وضعیت حامل بودن او را تعیین کرد. تشخیص افراد حامل با سنجش آنزیمی دشوار میباشد و همه جا مقدور نیست. اگر مادری حامل باشد هر یک از پسرانش به احتمال 50 درصد ژنهای جهش یافته را به ارث خواهند برد. اگر مادری دارای پسری مبتلا به هموفیلی باشد اما هیچ خویشاوند مبتلای دیگری نداشته باشد احتمال حامل بودن او 2 در 3 است.
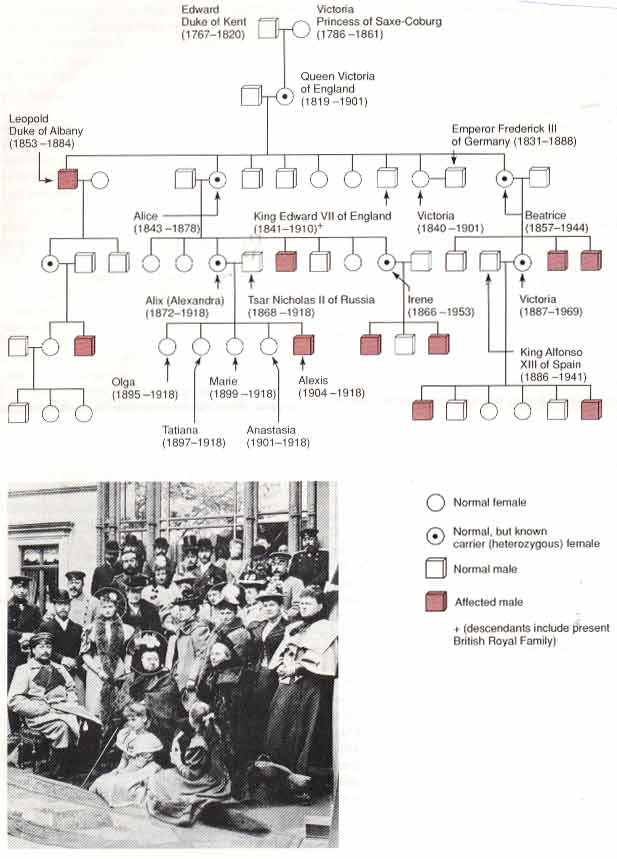
شجره نامه ی هموفیلی در خانواده ی ملکه ویکتوریا:
ویروس
 سلولهای زنده همواره در فعالیت میباشد. چون ویروسها در خارج از بدن میزبان به حالت خنثی بسر میبرند به این مفهوم نمیتوان آنها را موجود زنده در نظر گرفت. معهذا هنگامی که ویروسها وارد سلول میزبان میشوند اسیدهای نوکلئیک آنها فعال گشته و منجر به تکثیر ویروس میگردد. از نظر بالینی ویروسها را میتوان موجودات زنده در نظر گرفت زیرا آنها مانند باکتریها ، قارچهای بیماریزا آلودگی و بیماری ایجاد میکنند. به ویروس کامل ویریون گفته میشود.
سلولهای زنده همواره در فعالیت میباشد. چون ویروسها در خارج از بدن میزبان به حالت خنثی بسر میبرند به این مفهوم نمیتوان آنها را موجود زنده در نظر گرفت. معهذا هنگامی که ویروسها وارد سلول میزبان میشوند اسیدهای نوکلئیک آنها فعال گشته و منجر به تکثیر ویروس میگردد. از نظر بالینی ویروسها را میتوان موجودات زنده در نظر گرفت زیرا آنها مانند باکتریها ، قارچهای بیماریزا آلودگی و بیماری ایجاد میکنند. به ویروس کامل ویریون گفته میشود.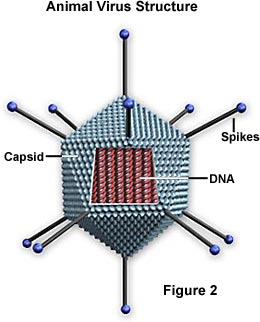
ساختمان شیمیایی ویروس
اسید نوکلئیک
 تا 50 درصد در برخی از باکتریوفاژها
تا 50 درصد در برخی از باکتریوفاژها متغیر است. برخلاف سلولهای پروکاریوتیک و یوکاریوتیک که همواره دارای DNA به عنوان ماده ژنتیکی اصلی خود هستند ویروسها دارای یکی از دو نوع اسید نوکلئیک بوده و هرگز هر دو را باهم ندارد. اسید نوکلئیک در بعضی ویروسها به شکل خطی و در بعضی به شکل حلقویمیباشد.
متغیر است. برخلاف سلولهای پروکاریوتیک و یوکاریوتیک که همواره دارای DNA به عنوان ماده ژنتیکی اصلی خود هستند ویروسها دارای یکی از دو نوع اسید نوکلئیک بوده و هرگز هر دو را باهم ندارد. اسید نوکلئیک در بعضی ویروسها به شکل خطی و در بعضی به شکل حلقویمیباشد.کپسید
پوشش غیر پروتئینی
 وکربوهیدراتها است پوشیده شده است.
وکربوهیدراتها است پوشیده شده است. ویروسهای ناقص Defctive Virus
 تشکیل شدهاند، ولی بدون ویروس کمکی توان تکثیر ندارند. که به این ویروس کمکی Helper ویروس گفته میشود. ویروسهای ناقص در ساختمان ژنتیکی خود نقصی دارند و در خلال تکثیر در داخل سلول بوجود میآیند و چون این ویروسها میتوانند تکثیر ویروسهای معمولی را مختل کنند تصور میشود که این ویروسها با تکثیر زیاد خود از تکثیر ویروسهای معمولی جلوگیری میکنند پس در بهبود بیماری نقش دارند.
تشکیل شدهاند، ولی بدون ویروس کمکی توان تکثیر ندارند. که به این ویروس کمکی Helper ویروس گفته میشود. ویروسهای ناقص در ساختمان ژنتیکی خود نقصی دارند و در خلال تکثیر در داخل سلول بوجود میآیند و چون این ویروسها میتوانند تکثیر ویروسهای معمولی را مختل کنند تصور میشود که این ویروسها با تکثیر زیاد خود از تکثیر ویروسهای معمولی جلوگیری میکنند پس در بهبود بیماری نقش دارند.ویریون
سودو ویریون
ویروتید
ویروسوئید

ویروسهای گیاهی
 ،قارچها
،قارچها ، گلسنگها ،خزهها ، سرخسها و گیاهان عالی دیده شدهاند. ولی در گیاهان عالی بیش از گیاهان پست مورد مطالعه قرار گرفتهاند. ویروسها به گیاهان زراعی خسارت عمدهای وارد میسازند. چون پارهای از ویروسهای گیاهی چندان شباهتی با ویروسهای دیگر ندارند بنابراین گروه مستقلی را تشکیل میدهند. ولی بعضی از آنها دارای خصوصیات مشترک بوده و میتوان آنها را در یک گروه قرار داد. این گروهها به شرح زیر هستند.
، گلسنگها ،خزهها ، سرخسها و گیاهان عالی دیده شدهاند. ولی در گیاهان عالی بیش از گیاهان پست مورد مطالعه قرار گرفتهاند. ویروسها به گیاهان زراعی خسارت عمدهای وارد میسازند. چون پارهای از ویروسهای گیاهی چندان شباهتی با ویروسهای دیگر ندارند بنابراین گروه مستقلی را تشکیل میدهند. ولی بعضی از آنها دارای خصوصیات مشترک بوده و میتوان آنها را در یک گروه قرار داد. این گروهها به شرح زیر هستند. - ویروسهای میلهای یا رشتهای
- ویروسهای ایزو دیامتریک
- ویروسهای باسیلی شکل
- ویروئیدها: بیماریزاهایی شبیه ویروسها هستند که در میزبان خود نوکلئو پروتئین تولید نمیکنند.

ویروسهای جانوری
ویروس از انواع مختلف جانوران از تک یاختگان تا انسان جدا شده است. میزبان مهم ویروسها در بیمهرهگان ، بندپایان هستند خصوصا کنهها و حشرات . پارهای از ویروسها در عین حال که در حشرات تکثیر مییابند میتوانند در گیاه یا در جانور مولد بیماری باشند، ولی برای خود حشرات بیماریزا محسوب نمیشوند. ویروسها در اکثر مهرهدارانفعالیت دارند و در ماهیها ، دوزیستان
. پارهای از ویروسها در عین حال که در حشرات تکثیر مییابند میتوانند در گیاه یا در جانور مولد بیماری باشند، ولی برای خود حشرات بیماریزا محسوب نمیشوند. ویروسها در اکثر مهرهدارانفعالیت دارند و در ماهیها ، دوزیستان ، پرندگان و پستانداران
، پرندگان و پستانداران بیماریهایی تولید میکنند که گاهی علایم آنها به صورت تومور نمایان میشود. ویروسها در انسان نیز بیماریهای گوناگونی مانند اوریون ، سرخک
بیماریهایی تولید میکنند که گاهی علایم آنها به صورت تومور نمایان میشود. ویروسها در انسان نیز بیماریهای گوناگونی مانند اوریون ، سرخک ، تب زرد ، آبله ، آنفلوانزا
، تب زرد ، آبله ، آنفلوانزا و ... ایجاد میکنند.
و ... ایجاد میکنند.
تکثیر ویروسها
اسید نوکلئیک هر ویریون فقط تعداد معدودی از ژنهای لازم برای سنتز ویروسهای جدید را دارا میباشد. اکثر آنزیمهای ویروسها توسط سلول میزبان ساخته میشوند. نقش آنزیمهای ویروس تقریبا بطور کامل با همانند سازی و آماده کردن اسید نوکلئیک ویروسی ارتباط دارد و هرگز با دستگاه سنتز پروتئینی را تولید انرژی رابطهای ندارد. مراحل 5 گانه تکثیر ویروس در سلول میزبان به صورت زیر است.
- مرحله رونشینی ویروسها بر روی سلول
- مرحله ورود و نفوذ در سلول
- مرحله بیوسنتز اجزای ویروسی
- مرحله رسیدن و کامل شدن ویروس
- مرحله آزاد شدن ویروس از سلول میزبان و نفوذ آن در سلولهای سالم
شیمی درمانی علیه ویروسها
داروهایی که در مراحل مختلف تکثیر ویروسها در بدن میزبان اثر میکنند در تجربیات آزمایشگاهی موثر شناخته شدهاند. ولی از نظر بالینی آمانتادین ، آسیکلوویر ، ویدارابین وتیو سمی کاربازون مفید شناخته شدهاند. در اغلب بیماریهای ویروسی تکثیر ویروس تقریبا قبل از ظاهر شدن علایم بیماری پایان پذیرفته است. مساله دیگر پیدایش ویروسهای جهش یافته مقاوم نسبت به این داروها میباشد و کثرت وقوع آنها به اندازه باکتریها میباشد.شیمی درمانی علیه ویروسها در مراحل اولیه است و میتوان در آینده داروهایی علیه ویروسها کشف کرد.
علیه ویروسها در مراحل اولیه است و میتوان در آینده داروهایی علیه ویروسها کشف کرد.
سلولهای بنیادی
سلولهای بنیادی
 تلاش برای استفاده از سلولهای بنیادی جنینی از حدود 20 سال پیش با کار بر روی حیوانات به ویژه موشهای آزمایشگاهی شروع شد. در طی این سالها، آزمایشات زیادی در جهت تبدیل سلولهای بنیادی جنینی موش به انواع سلولها و پیوند زدن آنها صورت گرفت که به موفقیتهای قابلتوجهی انجامید. در جوار این موضوع، سلولهای بنیادی انسان نیز مورد توجه قرار گرفت تا اینکه بالاخره در سال 1998 اولین گزارش موفقیتآمیز از تکثیر و تمایز سلولهای بنیادی جنینی انسان در آمریکا منتشر شد. اما با توجه به بروز برخی محدودیتها در تولید و استفاده از سلولهای بنیادی جنینی (که تلاش برای رفع آنها ادامه دارد) در چند سال اخیر، موج جدیدی از تحقیقات بر روی سلولهای بنیادی بالغ شروع شد که کماکان ادامه دارد.
تلاش برای استفاده از سلولهای بنیادی جنینی از حدود 20 سال پیش با کار بر روی حیوانات به ویژه موشهای آزمایشگاهی شروع شد. در طی این سالها، آزمایشات زیادی در جهت تبدیل سلولهای بنیادی جنینی موش به انواع سلولها و پیوند زدن آنها صورت گرفت که به موفقیتهای قابلتوجهی انجامید. در جوار این موضوع، سلولهای بنیادی انسان نیز مورد توجه قرار گرفت تا اینکه بالاخره در سال 1998 اولین گزارش موفقیتآمیز از تکثیر و تمایز سلولهای بنیادی جنینی انسان در آمریکا منتشر شد. اما با توجه به بروز برخی محدودیتها در تولید و استفاده از سلولهای بنیادی جنینی (که تلاش برای رفع آنها ادامه دارد) در چند سال اخیر، موج جدیدی از تحقیقات بر روی سلولهای بنیادی بالغ شروع شد که کماکان ادامه دارد.ایران بهعنوان یکی از معدود کشورهای تولیدکنندة سلولهای بنیادی جنینی
فناوری تولید و پرورش سلولهای بنیادی جنینی در دنیا کار جدیدی است؛ بهطوریکه پس از کشف سلولهای بنیادی جنینی موش در سال 1981، اولین سلولهای بنیادی جنینی انسان در سال 1998 تکثیر شد. در این میان، پس از چند کشور پیشرفته نظیر آمریکا، استرالیا، اسرائیل، سنگاپور، انگلستان، ژاپن، سوئد، هند و کرهجنوبی که به فناوری تکثیر و پرورش این سلولها دست پیدا کردهاند، ایران از جمله معدود کشورهایی است که به این مهم دست یافته است و لذا فاصله کشورمان در این مورد از دیگر کشورهای پیشرو چندان زیاد نیست.
منشأ سلولهای بنیادی بالغ
سلولهای بنیادی بالغ همانطور که از نامشان مشخص است، پس از تولد از فرد گرفته میشوند. برای مثال این سلولها را میتوان از بافت مغز استخوان یک فرد سالم تهیه کرد. البته بر اساس یافتههای اخیر، برخی معتقدند که هر بافتی دارای سلولهای بنیادی خاص خود است. بهطور مثال، مشخص شده که قلب، مغز و ماهیچههای اسکلتی هر کدام دارای سلولهای بنیادی خاص خود هستند و همة این سلولها در بدن یک فرد بالغ وجود دارند. بهعنوان مثال، سلولهای بنیادی قلبی بیشتر در ناحیه اپیکس (Apex) قلب و سلولهای بنیادی مغزی عمدتاً در دیوارة بطن مغز متمرکز هستند. با این حال دقیقاً مشخص نیست که منشأ این سلولهای بنیادی گوناگون، چه سلولی است و آیا منشأ همه اینها همان سلولهای مغز استخوان هستند که هر یک به سمت اندام خاصی مهاجرت کرده و به سلولهای بنیادی خاص آن تبدیل میشوند، یا منشأ دیگری برای آنها وجود دارد.
منشأ سلولهای بنیادی جنینی
 بنیاختههای جنینی در مرحله بلاستوسیست از تودة سلولی داخلی یا Inner Cell Mass گرفته میشوند. بلاستوسیست یکی از مراحل دوران جنینی است که به لحاظ مرفولوژی، شبیه یک توپ توخالی است.
بنیاختههای جنینی در مرحله بلاستوسیست از تودة سلولی داخلی یا Inner Cell Mass گرفته میشوند. بلاستوسیست یکی از مراحل دوران جنینی است که به لحاظ مرفولوژی، شبیه یک توپ توخالی است.
سلولهای محیط این توپ تروفوبلاست (Trophoblast) هستند که جفت را میسازند. در داخل این توپ هم تعدادی سلول جمع شدهاند که در مراحل بعدی، به جنین تبدیل میشوند. اگر این تودة سلولهای داخلی را برداشته و در محیط آزمایشگاهی کشت بدهند، بنیاختههای جنینی ایجاد میشوند. اما هنوز دقیقاً مشخص نیست که آیا این توده سلولهای داخلی منشأ بنیاختههای جنینی هستند، یا اینکه فرآیند مذکور، حاصل شرایط محیطی بوده و تودة سلولهای داخلی در محیط آزمایشگاهی سلولهای دیگری را میسازند که آنها به بنیاخته جنینی بدل میشوند.
تلومر
کارکرد و ویژگی های تلومر
 انتهای مولکول خطی که بطور معمول چسبنده میباشد با حضور تلومر و ساختمان آن این چسبندگی را از دست میدهد. از این رو تلومر مانند سپری کروموزم را از ایجاد پیوستگیهای نابجا و غیر صحیح و تخریب بهوسیله آنزیمهای اگزونوکلئاز سلول محافظت مینماید. همچنین، مشخص شده است که تلومر درمکان یابی و جایگیری کروموزم در هسته و خاموشی انتخابی ژنهای مجاور خود، ایفای نقش میکند علاوه برا ین، تلومر نقش اساسی دیگری در ابتدای سنتز خود ایفا میکند که در ارتباط با رونویسی میباشد. در واقع در انتهای یک DNA خطی کار آنزیم های همانند ساز در رشته پیرو به مشکل برخورد میکند چرا که این آنزیمها برای برداشتن آخرین پرایمر و قراردادن آخرین بازها، پایانه 'OH۳- را در اختیار ندارند. آنزیم تلومراز (Telomerase) این مشکل را با ستنز تلومر حل میکند.
انتهای مولکول خطی که بطور معمول چسبنده میباشد با حضور تلومر و ساختمان آن این چسبندگی را از دست میدهد. از این رو تلومر مانند سپری کروموزم را از ایجاد پیوستگیهای نابجا و غیر صحیح و تخریب بهوسیله آنزیمهای اگزونوکلئاز سلول محافظت مینماید. همچنین، مشخص شده است که تلومر درمکان یابی و جایگیری کروموزم در هسته و خاموشی انتخابی ژنهای مجاور خود، ایفای نقش میکند علاوه برا ین، تلومر نقش اساسی دیگری در ابتدای سنتز خود ایفا میکند که در ارتباط با رونویسی میباشد. در واقع در انتهای یک DNA خطی کار آنزیم های همانند ساز در رشته پیرو به مشکل برخورد میکند چرا که این آنزیمها برای برداشتن آخرین پرایمر و قراردادن آخرین بازها، پایانه 'OH۳- را در اختیار ندارند. آنزیم تلومراز (Telomerase) این مشکل را با ستنز تلومر حل میکند.
|
با توجه به اینکه در هر دور همانند سازی با فعالیت تلومر به طول تلومر افزوده میشود به نظر میرسد که اندازه تلومر پیوسته افزایش مییابد اما درواقع چنین مسئلهای رخ نمیدهد بلکه حتی در سلولهای سوماتیک جانداران پر سلولی مثل انسان طول تلومر پیوسته کاهش مییابد. این سلولها طی تمایز، توانائی تولید آنزیم تلومراز را از دست دادهاند بنابراین در هر دور همانند سازی در این سلولها آنزیمهای درگیر درانتهای تلومر با مشکل عدم وجود پایانه روبرو شده وقسمتی از انتهای تلومر همانند سازی نمیگردد. این مسئله طی تقسیمات متوالی باعث کاهش تدریجی طول تلومر میگردد.
 البته سلولهای سوماتیکی که به سرعت تقسیم میشوند و سلولهای تولید مثلیٍ، توانائی تولیدمثل تلومراز را دارند وبنابراین دچار این کاهش در طول تلومر نمیگردد.
البته سلولهای سوماتیکی که به سرعت تقسیم میشوند و سلولهای تولید مثلیٍ، توانائی تولیدمثل تلومراز را دارند وبنابراین دچار این کاهش در طول تلومر نمیگردد.علاوه بر آنچه بالا گفته شد احتمال وجود سیستم کاهش طول وابسته به پروتئین که به اصطلاح باعث فرسایش یا خوردگی تلومر میشود نیز مطرح شده است.
مشاهدات نشان داده است که در بین سلولهای سوماتیک سلولهای عصبی در رابطه با طول تلومر استثنا میباشند. چراکه در این سلولها طول تلومر همواره تقریباٌ ثابت باقی میماند. باتوجه به اینکه این سلولها پس ازدوران جنینی بطور معمول تقسیم نمیشوند ثبات طول تلومر در آنها مکانیزم کاهش طول تلومر براساس همانند سازی ناقص و یا هر مکانیزم دیگر را که وابسته به تقسیم سلولی باشد تائید میکند.
سوالی که در اینجا مطرح میگردد این است که آیا در سلولهایی که بطور مداوم تقسیم میشوند مثل سلولهای تولید مثلی و یا تک سلولیهای یوکاریوتیک که در آنها تقسیم سلولی به معنای تولید نسل است و بدون محدودیت دنبال میشود، طول تلومر به علت وجود آنزیم تلومراز پیوسته افزایش مییابد؟
مشاهدات و آزمایشات انجام شده بر روی سلولهای مخمر نشان دادهاند که نوعی تعادل بین کاهش وافزایش طول تلومر در این سلولها وجود دارد. بدین صورت که سیستمهای مولکولی خاصی با کاهش تدریجی طول تلومر و رسیدن آن به یک آستانه معین امکان افزایش طول آنرا فراهم میآورند.
به عنوان مثال پیشنهاد شده است که پروتئین متصل شونده به تلومر به نامTelomere Binding Protein دارای تعدادی جایگاه اتصال روی تلومر است ،هرگاه که این پروتئین به تعداد معین ( و یا بیشتر از آن ) در اتصال با تلومر وجود داشته باشد تلومراز امکان اتصال و سنتز دنباله تلومر را نمییابد. اما وقتی به علت کاهش طول تلومر، چه با فرسایش و چه با همانند سازی ناقص، تعداد جایگاههای TBPو در نتیجه تعداد مولکولهای این پروتئین بر روی تلومر کاهش پیدا کند، تلومراز اجازه مییابد به تلومر متصل شده و آنرا طویل کند این طویل شدن باعث ایجاد جایگاههای جدید برای اتصال تعدادی از مولکولهای این پروتئین به تلومر میشود که این امر دوباره باعث جلوگیری از افزایش طول مجدد
تلومر توسط تلومراز شده و تعادل بین کاهش وافزایش طول حفظ میشود.
همانطورتلومر و طول عمر که گفته شد وجود تلومر به عنوان سپر حفاظتی برای محافظت از ژنوم سلول یوکاریوتی اهمیت حیاتی دارد وکاهش زیاد طول تلومر منجر به از بین رفتن توانائی عملکرد این ساختار در انجام وظایف خود شده ودرنهایت سلول را به سوی نابودی میبرد. مشاهدات متعدد نشان دادهاند که سلولهای سوماتیک انسانی طبیعی، که در سیستم در شیشه(in vitro)کشت داده شدهاند ،تنها میتوانند تعداد محدودی تقسیم را انجام دهد و پس از آن رشد آنها متوقف شده و سلولها دچار سالخوردگی میشوند پس از اینکه کاهش طول تلومر به حد بحرانی برسد فرکانس بالائی از نوترکیبیهای کروموزمی مشاهده میشود همین امر میتواند عامل سالخوردگی ونهایتاٌ نابودی سلول گردد. این اتفاق دربدن موجودات زنده (in vivo) نیز رخ میدهد و تحقیقات ارتباط طول عمر موجودات زنده پرسلولی وکاهش طول تلومر را نشان میدهند. به عنوان مثال در یک بررسی بر روی Rat مشاهده شد که کاهش طول عمر تلومر در بافتهای سوماتیک این جانور در جنس نر بیشتر ( سریعتر ) از جنس ماده است.و این مطلب با طول عمر آنها که در مادهها بیش از نرهاست مطابقت دارد.
همین مسئله باعث شد که بحثهائی پیرامون افزایش مدت عمر بشر وحتی جاودانگی بشر مطرح گردد و دانشمندان در تلاش هستند که ابتدا اینکار را با ساختن حیوانات آزمایشگاهی مثلاٌ موشهائی با عمرهای طولانی تر ازحد معمول به مرحله عمل برسانند.

تلومر و سرطان
برخلاف سلولهای سوماتیک طبیعی، سلولهای سرطانی میتوانند بطورمتوالی تقسیم شده و خطوط سلولی نامحدود تولید نمایند. ( مثل سلولهای هلا) برای داشتن چنین خصوصیتی، این سلولها باید توانائی حفظ طول تلومر خود را داشته باشند. این سلولها میتوانند این توانائی را با تولید آنزیم تلومراز بدست آوردند. در واقع ایجاد توانائی تولید این آنزیم که میتواند توسط ویروسها و یا سایر عوامل جهش زا، در سلولهای سوماتیک بدن ایجاد گردد یکی از عوامل سرطانی شدن این سلولها بشمار میرود.
از سوی دیگر همین مسئله از سوی پژوهشگران به عنوان پاشنه آشیلی برای سلولهای سرطانی تلقی میشود. چراکه با طراحی درمانهائی که ساز و کار حفظ تلومر را در این سلولها هدف قرار میدهد میتوان این سلولهای نامیرا را به سلولهایی با تقسیمات محدود و درواقع میرا تبدیل کرده و نابود نمود.
یکی از راحترین راهها برای انجام اینکار هدف قراردادن تلومراز است. چراکه این آنزیم مسئول نامیرائی در سلولهای سرطانی است. اما از سوی دیگر مشخص شده است که گاهی چنین مباررزهای تأثیر معکوس میدهد به عنوان مثال در یک مطالعه درموشهای آزمایشگاهی مشاهده شده است که این نوع درمان اگر چه باعث کاهش توان حیاتی سلولهای سرطانی میشود اما فراوانی لنفوما را در این موشها افزایش میدهد. این امر ممکن است به علت افزایش امکان ایجاد نابسامانیهای کروموزمی به علت کاهش طول تلومرها باشد به بیان دیگر در این روش امکان بوجود آمدن خطوط سلولی جدید که نسبت به درمان مقاومت نشان میدهند وجود دارد.
ایراد دیگر این روش این است که پس از تحت تأثیر قرار دادن آنزیم تلومراز ( که به طرق مختلف مثلاٌ طراحی شناساگرهای مکمل برای بخش RNA این ریبونوکلئوپروتئین که کار آن را مختل میکند،امکانپذیر است) بایدمنتظر ماند تا عوامل کاهش طول تلومر به تدریج اندازه تلومرها را کاهش دهند و این امر مستلزم سپری شدن چندین مرحله تقسیم سلولی است. بنابراین، درمانهای مبتنی بر توقف فعالیت تلومراز نمیتوانند بطور مستقیم وبی واسطه بر سلولهای سرطانی تأثیر گذار باشند وراه بهتر برای انجام درمان براساس تلومر هدف قراردادن پروتئینهای شرکت کننده در ساختمان آن برای از هم پاشاندن این ساختار و یا هدف قراردادن پروتئینهای شرکت کننده در مسیرها و واکنشهای منتهی به ایجاد ساختار و یا هدف قراردادن پروتئینهای آن میباشد.که این امر خود مستلزم شناخت دقیقتر از ساختمان تلومر و چگونگی تشکیل آن با انجام پژوهشهای بیشتر در این زمینه است.